Notice : Information de l’utilisateur
ADVATE 250 UI poudre et solvant pour solution injectable
ADVATE 500 UI poudre et solvant pour solution injectable
ADVATE 1000 UI poudre et solvant pour solution injectable
ADVATE 1500 UI poudre et solvant pour solution injectable
ADVATE 2000 UI poudre et solvant pour solution injectable
ADVATE 3000 UI poudre et solvant pour solution injectable
octocog alfa (facteur VIII de coagulation humain recombinant)
Veuillez lire attentivement l’intégralité de cette notice avant d’utiliser ce médicament car elle contient des informations importantes pour vous.
- Gardez cette notice. Vous pourriez avoir besoin de la relire.
- Si vous avez d’autres questions, interrogez votre médecin.
- Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
- Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
Que contient cette notice ?
- 1. QU’EST-CE QU’ADVATE ET DANS QUEL CAS EST‑IL UTILISÉ ?
- 2. QUELLES SONT LES INFORMATIONS À CONNAÎTRE AVANT D’UTILISER ADVATE ?
- 3. COMMENT UTILISER ADVATE ?
- 4. QUELS SONT LES EFFETS INDÉSIRABLES ÉVENTUELS ?
- 5. COMMENT CONSERVER ADVATE ?
- 6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
- 6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
- 6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
- 6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
1. QU’EST-CE QU’ADVATE ET DANS QUEL CAS EST‑IL UTILISÉ ?
ADVATE contient la substance active octocog alfa, facteur VIII de coagulation humain, produit par la technique de l’ADN recombinant. Le facteur VIII est nécessaire au sang pour former un caillot sanguin et arrêter le saignement. Chez les patients atteints d’hémophilie A (manque congénital de facteur VIII), le facteur VIII est absent ou ne fonctionne pas correctement.
ADVATE est utilisé pour la prévention et le traitement des saignements chez les patients de tous les groupes d'âge atteints d'hémophilie A (trouble héréditaire de la coagulation dû à un manque de facteur VIII).
ADVATE est produit sans addition de protéine d’origine humaine ou animale tout au long de son processus de fabrication.
2. QUELLES SONT LES INFORMATIONS À CONNAÎTRE AVANT D’UTILISER ADVATE ?
N’utilisez jamais ADVATE
- si vous êtes allergique à l'octocog alfa, ou à l'un des autres composants contenus dans ce médicament (mentionnés dans la rubrique 6),
- si vous êtes allergique aux protéines de souris ou de hamster.
En cas de doute, n'hésitez pas à demander l'avis de votre médecin.
Avertissements et précautions
Adressez-vous à votre médecin avant d’utiliser ADVATE. Vous devez informer votre médecin, si vous avez été précédemment traité avec un facteur VIII et plus particulièrement si vous avez développé des inhibiteurs, dans la mesure où il existe un risque plus grand qu’ils apparaissent encore. Les inhibiteurs sont des anticorps neutralisants contre le facteur VIIIqui peuvent diminuer l'efficacité d’ADVATE à prévenir et contrôler les saignements. Le développement d’inhibiteurs est une complication connue du traitement de l’hémophilie A. Si votre saignement n’est pas contrôlé avec ADVATE, informez-en immédiatement votre médecin.
Il existe un très faible risque que vous développiez une réaction anaphylactique (réaction allergique soudaine et sévère) à ADVATE. Vous devez être informé des signes précoces des réactions d’hypersensibilité tels qu’éruptions cutanées, urticaire, érythème, éruption prurigineuse généralisée, gonflement des lèvres et de la langue, difficulté respiratoire, respiration sifflante, oppression thoracique, sensation générale de malaise et étourdissement. Ces symptômes peuvent constituer les signes précoces d’un choc anaphylactique, dont la manifestation peut aussi inclure un état vertigineux, une perte de connaissance et une difficulté respiratoire extrême.
Si l’un de ces symptômes apparait, l’injection doit être immédiatement arrêtée et vous devez contacter votre médecin. En cas de symptômes sévères, détresse respiratoire et (presque) évanouissement, un traitement d’urgence devra être instauré.
Patients développant des inhibiteurs du facteur VIII
L’apparition d’inhibiteurs du facteur VIII est une complication connue pouvant survenir pendant le traitement avec un médicament contenant du facteur VIII, peu importe lequel. Ces inhibiteurs, notamment à une forte concentration, empêchent le traitement d’être efficace ; vous ou votre enfant serez donc surveillé étroitement afin de déceler l’apparition de ces inhibiteurs. Si un saignement n’est pas correctement contrôlé avec ADVATE, informez-en immédiatement votre médecin.
Enfants et adolescents
La liste des avertissements et des précautions s’applique aussi bien aux adultes qu’aux enfants (de 0 à 18 ans).
Autres médicaments et ADVATE
Informez votre médecin si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
Grossesse et allaitement
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin avant de prendre ce médicament.
Conduite de véhicules et utilisation de machines
ADVATE n’a aucun effet sur l'aptitude à conduire des véhicules ou à utiliser des machines.
ADVATE contient du sodium
Ce médicament contient 10 mg de sodium (composant principal du sel de cuisine/table) par flacon. Cela équivaut à 0,5 % de l'apport alimentaire quotidien maximal recommandé de sodium pour un adulte.
3. COMMENT UTILISER ADVATE ?
Le traitement avec ADVATE sera initié sous la responsabilité d’un médecin expérimenté dans le traitement des patients atteints d’hémophilie A.
Votre médecin calculera la dose d’ADVATE qui vous convient (en unités internationales ou UI) en fonction de votre état clinique et de votre poids, selon qu’il s’agit de la prévention ou du traitement des saignements. La fréquence des administrations dépendra de l’efficacité d’ADVATE sur vous.
Habituellement, le traitement substitutif par ADVATE est un traitement à vie.
Veillez à toujours utiliser ce médicament en suivant exactement les indications de votre médecin. Vérifiez auprès de votre médecin en cas de doute.
Prévention des saignements
La dose habituelle d’octocog alfa se situe entre 20 et 40 UI par kilogramme de poids corporel, administrée tous les 2 à 3 jours.
Toutefois, dans certains cas, surtout chez le sujet jeune, des intervalles plus rapprochés ou des doses plus élevées peuvent être nécessaires.
Traitement des saignements
La dose d’octocog alfa est calculée en fonction de votre poids et du taux de facteur VIII à atteindre.
Le taux de facteur VIII à atteindre dépendra de la sévérité et de la localisation des saignements.
Dose (UI) = poids corporel (kg) x augmentation souhaitée du taux de Facteur VIII (% de la normale) x 0,5
Si vous avez l’impression que l’effet d’ADVATE est insuffisant, n’hésitez pas à en parler à votre médecin.
Votre médecin pratiquera les examens biologiques appropriés afin de vérifier que vous présentez le taux plasmatique souhaité de facteur VIII. Ceci est particulièrement important en cas de chirurgie majeure.
Utilisation chez les enfants et les adolescents (de 0 à 18 ans)
Pour le traitement des saignements, la posologie chez les patients pédiatriques ne diffère pas de celle des patients adultes. Pour la prévention des saignements chez les patients de moins de 6 ans, les doses recommandées sont de 20 à 50 UI par kg de poids corporel 3 à 4 fois par semaine. L'administration d'ADVATE chez les enfants (par voie intraveineuse) ne diffère pas de l’administration chez les adultes. Un dispositif d'accès veineux central (DAVC) peut s'avérer nécessaire afin de permettre des perfusions fréquentes de facteur VIII.
Comment administrer ADVATE ?
ADVATE est injecté dans une veine (par voie intraveineuse) soit par votre médecin ou votre infirmière. Vous ou une autre personne peut aussi vous administrer ADVATE par voie intraveineuse mais seulement après avoir suivi une formation appropriée. Les instructions détaillées pour une auto‑administration sont données à la fin de cette notice.
Si vous avez utilisé plus d'ADVATE que vous n’auriez dû :
Il est recommandé d’utiliser ADVATE exactement comme votre médecin vous l’a dit. Vous devez vérifier avec votre médecin si vous n’êtes pas sûr. Si vous avez reçu plus d’ADVATE que vous n’auriez dû, informez immédiatement votre médecin.
Si vous oubliez de prendre ADVATE :
Ne vous injectez pas une double dose pour compenser la dose que vous avez oublié de prendre. Procédez à l'injection suivante prévue puis continuez comme indiqué par votre médecin.
Si vous arrêtez de prendre ADVATE :
Ne pas interrompre le traitement d’ADVATE sans consulter votre médecin.
Si vous avez des questions concernant l'utilisation de ce médicament, demandez conseil à votre médecin
4. QUELS SONT LES EFFETS INDÉSIRABLES ÉVENTUELS ?
Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, mais ils ne surviennent pas systématiquement chez tout le monde.
En cas de survenue de réactions allergiques (anaphylactiques) soudaines et graves, arrêtez immédiatement l'injection.
Consultez immédiatement votre médecin en cas d’apparition de signes précoces des réactions allergiques telles que :
- éruption cutanée, urticaire, érythème, éruption prurigineuse généralisée,
- gonflement des lèvres et de la langue,
- difficulté respiratoire, respiration sifflante, oppression thoracique,
- sensation générale de malaise,
- étourdissement, perte de connaissance
Des symptômes sévères tels qu’une difficulté respiratoire extrême, un évanouissement (ou presque) nécessitent immédiatement un traitement d’urgence.
Chez les enfants n’ayant jamais été traités par un médicament contenant du facteur VIII, des inhibiteurs, ou anticorps, (voir rubrique 2) peuvent apparaître de façon très fréquente (plus d’1 personne sur 10). Cependant, chez les patients ayant déjà reçu un traitement par un médicament contenant du facteur VIII pendant plus de 150 jours, ce risque est peu fréquent (moins d’1 personne sur 100). En cas d’apparition d’inhibiteurs, le traitement cessera d’être efficace et vous, ou votre enfant, pourriez avoir un saignement persistant. Dans ce cas, consultez immédiatement votre médecin.
Effets indésirables très fréquents (peuvent toucher plus d’1 personne sur 10)
inhibiteurs du facteur VIII (chez les enfants n’ayant jamais été traités par un médicament contenant du facteur VIII).
Effets indésirables fréquents (peuvent toucher jusqu'à 1 personne sur 10)
maux de tête et fièvre.
Effets indésirables peu fréquents (peuvent toucher jusqu'à 1 personne sur 100)
inhibiteurs du facteur VIII (chez les patients ayant déjà reçu un traitement par un médicament contenant du facteur VIII (pendant plus de 150 jours)), vertiges, grippe, évanouissements, battements cardiaques anormaux, bosses rouges qui grattent sur la peau, inconfort thoracique, bleus au site d’injection, réaction au site d’injection, démangeaisons, transpiration augmentée, goût inhabituel dans la bouche, bouffées de chaleur, migraines, troubles de la mémoire, frissons, diarrhées, nausées, vomissements, essoufflement, mal de gorge, infection des vaisseaux lymphatiques, blanchissement de la peau, inflammation oculaire, rashs, transpiration excessive, gonflement des pieds et des jambes, diminution de l’hématocrite, augmentation d’un certain type de globules blancs (monocytes) et douleur dans la partie supérieure de l’abdomen ou la partie inférieure de la poitrine.
Liés à une intervention chirurgicale :
infection liée au cathéter, baisse du taux de globules rouges, gonflement des membres et des articulations, saignement prolongé après retrait du drain, diminution du taux de facteur VIII et hématome postopératoire.
Liés aux dispositifs d'accès veineux central (DAVC)
infection liée au cathéter, infection systémique et caillot sanguin local au site du cathéter.
Effets indésirables de fréquence indéterminée (la fréquence ne peut être estimée à partir des données disponibles)
réactions mettant potentiellement en jeu le pronostic vital (anaphylaxie) et autres réactions allergiques (hypersensibilité), troubles généraux (fatigue, manque d'énergie).
Effets indésirables supplémentaires chez les enfants
Outre le développement d’inhibiteurs chez des patients pédiatriques non préalablement traités (PUPs), et les complications liées au cathéter, aucune différence d’effets indésirables liée à l’âge n'a été constatée au cours des études cliniques.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via :
Belgique
Agence fédérale des médicaments et des produits de santé
Division Vigilance
Avenue Galilée 5/03 | Boîte Postale 97 |
Site internet: www.notifieruneffetindesirable.be
e-mail: adr@afmps.be
Luxembourg
Centre Régional de Pharmacovigilance de Nancy
Bâtiment de Biologie Moléculaire et de Biopathologie (BBB)
CHRU de Nancy – Hôpitaux de Brabois
Rue du Morvan
54 511 VANDOEUVRE LES NANCY CEDEX
Tél: (+33) 3 83 65 60 85 / 87
e-mail: crpv@chru-nancy.fr
ou
Direction de la Santé
Division de la Pharmacie et des Médicaments
20, rue de Bitbourg
L-1273 Luxembourg-Hamm
Tél.: (+352) 2478 5592
e-mail: pharmacovigilance@ms.etat.lu
Link pour le formulaire : https://guichet.public.lu/fr/entreprises/sectoriel/sante/medecins/notification-effets-indesirables-medicaments.html
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER ADVATE ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption figurant sur l’étiquette après la mention EXP. La date de péremption se rapporte au dernier jour du mois.
A conserver au réfrigérateur (entre +2ºC et +8ºC).
Ne pas congeler.
Pendant la durée de conservation, le flacon de poudre peut être conservé à température ambiante (ne dépassant pas 25 °C) pendant une période unique de 6 mois maximum. Dans ce cas, ce médicament expire à la fin de la période de 6 mois ou à la date d’expiration imprimée sur le flacon du produit si celle-ci précède la fin de cette période de 6 mois. Noter la date de fin des 6 mois de conservation à température ambiante sur l’emballage. Une fois le produit conservé à température ambiante, il ne doit pas être remis au réfrigérateur.
Conserver le flacon dans l’emballage extérieur à l'abri de la lumière.
Ce produit est à usage unique. Toute solution non utilisée doit être éliminée de manière appropriée.
Utiliser le produit immédiatement lorsque la poudre est complètement dissoute.
Ne pas réfrigérer la solution après préparation.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient ADVATE
- La substance active est l’octocog alfa (facteur VIII de coagulation humain produit par la technique de l’ADN recombinant.). Chaque flacon de poudre contient nominalement 250, 500, 1000, 1500, 2000 ou 3000 UI d’octocog alfa.
- Les autres composants sont : mannitol, chlorure de sodium, histidine, tréhalose, chlorure de calcium, trométamol, polysorbate 80 et glutathion (réduit).
Flacon de solvant : 5 ml d’eau pour préparations injectables stérilisée
Qu’est ce qu’ADVATE et contenu de l’emballage extérieur
ADVATE est une poudre friable de couleur blanche à légèrement grise. Après reconstitution, la solution est claire, limpide et exempte de particules.
Chaque coffret comprend un dispositif pour la reconstitution (BAXJECT II).
Titulaire de l’Autorisation de mise sur le marché :
Takeda Manufacturing Austria AG
Industriestrasse 67
A‑1221Vienne
Tél: +800 66838470
e-mail: medinfoEMEA@takeda.com
Fabricants :
Baxalta Belgium Manufacturing SA
Boulevard René Branquart 80
B‑7860 Lessines
Belgique
Pour toute information complémentaire concernant ce médicament, veuillez prendre contact avec le représentant local du titulaire de l’autorisation de mise sur le marché :
België/Belgique/Belgien | Lietuva | ||
България | Luxembourg/Luxemburg | ||
Česká republika | Magyarország | ||
Danmark | Malta | ||
Deutschland | Nederland | ||
Eesti | Norge | ||
Ελλάδα | Österreich | ||
España | Polska | ||
France | Portugal | ||
Hrvatska | România | ||
Ireland | Slovenija | ||
Ísland | Slovenská republika | ||
Italia | Suomi/Finland | ||
Κύπρος | Sverige | ||
Latvija | United Kingdom (Northern Ireland) | ||
La dernière date à laquelle cette notice a été révisée est le 07/2022.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’Agence européenne du médicament http://www.ema.europa.eu/.
‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑
Instructions pour la préparation et l’administration
Des techniques aseptiques sont nécessaires pendant la reconstitution et l'administration.
Pour la reconstitution, utiliser uniquement l’eau pour préparations injectables stérilisée et le nécessaire de reconstitution et d’administration fournis dans chaque coffret d’ADVATE. ADVATE ne doit pas être mélangé avec d'autres médicaments ou solvants.
Il est fortement recommandé qu’à chaque administration d’ADVATE, le nom et le numéro de lot du produit soient enregistrés.
Instructions pour la reconstitution
- Ne pas utiliser le produit après la date de péremption indiquée sur les étiquettes et le carton.
- Ne pas utiliser si le dispositif BAXJECT II, l’opercule ou l’emballage est endommagé ou présente des signes de détérioration comme indiqué par ce symbole
 .
. - Ne pas réfrigérer la solution après préparation.
1. Si le produit est encore stocké au réfrigérateur, sortir les flacons de poudre ADVATE (poudre) et de solvant du réfrigérateur et laisser les atteindre la température ambiante (entre 15 °C et 25 °C).
2. Lavez‑vous soigneusement les mains à l’eau chaude et au savon.
3. Retirer les opercules des flacons de poudre et de solvant.
4. Nettoyer les bouchons avec les tampons d’alcool. Disposer les flacons sur une surface plane et propre.
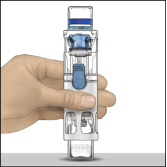
5. Ouvrir l’emballage de BAXJECT II en retirant le couvercle sans toucher l’intérieur (Fig. a). Ne pas retirer le dispositif de l’emballage. Ne pas utiliser si le dispositif BAXJECT II, l’opercule ou l’emballage est endommagé ou présente des signes de détérioration.
6. Retourner l’emballage et insérer le perforateur en plastique transparent dans le bouchon du flacon de solvant. Saisir l’emballage sur les côtés puis retirer l’emballage du dispositif BAXJECT II (Fig. b). Ne pas retirer le capuchon bleu du dispositif BAXJECT II.
7. Pour la reconstitution, n’utilisez que l’eau pour préparations injectables stérilisée et le dispositif médical fournis. En maintenant le dispositif BAXJECT II solidaire du flacon de solvant, tourner le système sur lui‑même de sorte que le flacon de solvant se trouve en haut.
Insérer le perforateur en plastique blanc dans le bouchon du flacon de poudre ADVATE. Le vide entraînera le solvant vers le flacon de poudre ADVATE (Fig. c).
8. Agiter doucement jusqu’à ce que toute la poudre soit dissoute. Bien vérifier que la poudre ADVATE est complètement dissoute, sinon la totalité de la solution reconstituée ne passera pas au travers du filtre. Le produit se dissout rapidement (en général en moins d’une minute). Après reconstitution, la solution doit être limpide, incolore et exempte de particules.
Fig. a Fig. b Fig. c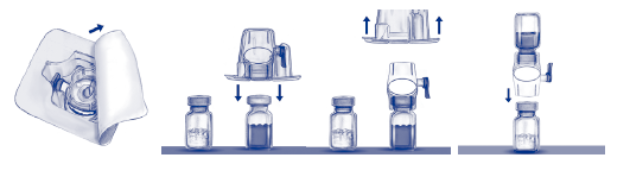
Instructions pour l’injection
Pour l’administration, il est recommandé d’utiliser une seringue Luer Lock.
Remarque importante
- Ne pas tenter d’injecter à moins d’avoir reçu une formation particulière de votre médecin ou infirmière.
- Inspecter la solution reconstituée avant utilisation pour vérifier l’absence de particules et une coloration éventuelle (la solution doit être limpide, incolore et exempte de particules.)
Ne pas utiliser ADVATE si la solution n’est pas limpide ou la poudre n’est pas complètement dissoute.
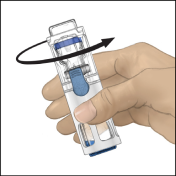
1. Retirer l’opercule bleu du dispositif BAXJECT II. Ne pas remplir la seringue d'air. Connecter la seringue au dispositif BAXJECT II (Fig. d).
2. Retourner le système (le flacon contenant la solution reconstituée doit être désormais en position haute). Remplir la seringue avec la solution reconstituée en tirant lentement le piston en arrière (Fig. e).
3. Retirer la seringue.
4. Fixer l’aiguille à ailette à la seringue et injecter la solution reconstituée par voie intraveineuse. La solution devra être administrée lentement à une vitesse d’administration qui devra tenir compte du confort du patient en ne dépassant pas 10 ml/minute. (voir la rubrique 4 "Quels sont les effets indésirables éventuels").
5. Toute solution non utilisée doit être éliminée de manière appropriée.
Fig. d Fig. e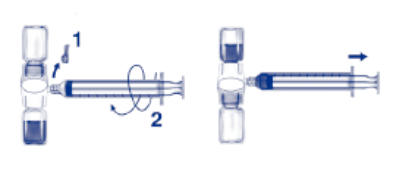
‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑
Les informations suivantes sont destinées aux professionnels de santé uniquement :
Traitement à la demande
Dans les différentes situations hémorragiques suivantes, l'activité en facteur VIII ne doit pas chuter en dessous de l’activité indiquée (en % de la normale ou en UI/dl) pendant la période concernée. Le tableau suivant peut servir de guide pour les posologies lors d’épisodes hémorragiques ou de chirurgie.
La dose et la fréquence d'administration doivent être adaptées à la réponse clinique de chaque individu. Dans certaines circonstances (ex : présence d’inhibiteur à faible titre), des doses plus importantes que celles calculées peuvent être nécessaires.
Degré de l'hémorragie / type d'intervention chirurgicale | Niveau de Facteur VIII nécessaire (% ou UI/dl) | Fréquence des doses (heures) / durée du traitement (jours) |
Hémorragie | | |
Chirurgie | | |
Notice : Information de l’utilisateur
ADVATE 250 UI poudre et solvant pour solution injectable
ADVATE 500 UI poudre et solvant pour solution injectable
ADVATE 1000 UI poudre et solvant pour solution injectable
ADVATE 1500 UI poudre et solvant pour solution injectable
ADVATE 2000 UI poudre et solvant pour solution injectable
ADVATE 3000 UI poudre et solvant pour solution injectable
octocog alfa (facteur VIII de coagulation humain recombinant)
Veuillez lire attentivement l’intégralité de cette notice avant d’utiliser ce médicament car elle contient des informations importantes pour vous.
- Gardez cette notice. Vous pourriez avoir besoin de la relire.
- Si vous avez d’autres questions, interrogez votre médecin.
- Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
- Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
ADVATE contient la substance active octocog alfa, facteur VIII de coagulation humain, produit par la technique de l’ADN recombinant. Le facteur VIII est nécessaire au sang pour former un caillot sanguin et arrêter le saignement. Chez les patients atteints d’hémophilie A (manque congénital de facteur VIII), le facteur VIII est absent ou ne fonctionne pas correctement.
ADVATE est utilisé pour la prévention et le traitement des saignements chez les patients de tous les groupes d'âge atteints d'hémophilie A (trouble héréditaire de la coagulation dû à un manque de facteur VIII).
ADVATE est produit sans addition de protéine d’origine humaine ou animale tout au long de son processus de fabrication.
N’utilisez jamais ADVATE
- si vous êtes allergique à l'octocog alfa, ou à l'un des autres composants contenus dans ce médicament (mentionnés dans la rubrique 6),
- si vous êtes allergique aux protéines de souris ou de hamster.
En cas de doute, n'hésitez pas à demander l'avis de votre médecin.
Avertissements et précautions
Adressez-vous à votre médecin avant d’utiliser ADVATE. Vous devez informer votre médecin, si vous avez été précédemment traité avec un facteur VIII et plus particulièrement si vous avez développé des inhibiteurs, dans la mesure où il existe un risque plus grand qu’ils apparaissent encore. Les inhibiteurs sont des anticorps neutralisants contre le facteur VIII qui peuvent diminuer l'efficacité d’ADVATE à prévenir et contrôler les saignements. Le développement d’inhibiteurs est une complication connue du traitement de l’hémophilie A. Si votre saignement n’est pas contrôlé avec ADVATE, informez-en immédiatement votre médecin.
Il existe un très faible risque que vous développiez une réaction anaphylactique (réaction allergique soudaine et sévère) à ADVATE. Vous devez être informé des signes précoces des réactions d’hypersensibilité tels qu’éruptions cutanées, urticaire, érythème, éruption prurigineuse généralisée, gonflement des lèvres et de la langue, difficulté respiratoire, respiration sifflante, oppression thoracique, sensation générale de malaise et étourdissement. Ces symptômes peuvent constituer les signes précoces d’un choc anaphylactique, dont la manifestation peut aussi inclure un état vertigineux, une perte de connaissance et une difficulté respiratoire extrême.
Si l’un de ces symptômes apparait, l’injection doit être immédiatement arrêtée et vous devez contacter votre médecin. En cas de symptômes sévères, détresse respiratoire et (presque) évanouissement, un traitement d’urgence devra être instauré.
Patients développant des inhibiteurs du facteur VIII
L’apparition d’inhibiteurs du facteur VIII est une complication connue pouvant survenir pendant le traitement avec un médicament contenant du facteur VIII, peu importe lequel. Ces inhibiteurs, notamment à une forte concentration, empêchent le traitement d’être efficace ; vous ou votre enfant serez donc surveillé étroitement afin de déceler l’apparition de ces inhibiteurs. Si un saignement n’est pas correctement contrôlé avec ADVATE, informez-en immédiatement votre médecin.
Enfants et adolescents
La liste des avertissements et des précautions s’applique aussi bien aux adultes qu’aux enfants (de 0 à 18 ans).
Autres médicaments et ADVATE
Informez votre médecin si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
Grossesse et allaitement
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin avant de prendre ce médicament.
Conduite de véhicules et utilisation de machines
ADVATE n’a aucun effet sur l'aptitude à conduire des véhicules ou à utiliser des machines.
ADVATE contient du sodium
Ce médicament contient 10 mg de sodium (composant principal du sel de cuisine/table) par flacon. Cela équivaut à 0,5 % de l'apport alimentaire quotidien maximal recommandé de sodium pour un adulte.
Le traitement avec ADVATE sera initié sous la responsabilité d’un médecin expérimenté dans le traitement des patients atteints d’hémophilie A.
Votre médecin calculera la dose d’ADVATE qui vous convient (en unités internationales ou UI) en fonction de votre état clinique et de votre poids, selon qu’il s’agit de la prévention ou du traitement des saignements. La fréquence des administrations dépendra de l’efficacité d’ADVATE sur vous.
Habituellement, le traitement substitutif par ADVATE est un traitement à vie.
Veillez à toujours utiliser ce médicament en suivant exactement les indications de votre médecin. Vérifiez auprès de votre médecin en cas de doute.
Prévention des saignements
La dose habituelle d’octocog alfa se situe entre 20 et 40 UI par kilogramme de poids corporel, administrée tous les 2 à 3 jours.
Toutefois, dans certains cas, surtout chez le sujet jeune, des intervalles plus rapprochés ou des doses plus élevées peuvent être nécessaires.
Traitement des saignements
La dose d’octocog alfa est calculée en fonction de votre poids et du taux de facteur VIII à atteindre.
Le taux de facteur VIII à atteindre dépendra de la sévérité et de la localisation des saignements.
Dose (UI) = poids corporel (kg) x augmentation souhaitée du taux de Facteur VIII (% de la normale) x 0,5
Si vous avez l’impression que l’effet d’ADVATE est insuffisant, n’hésitez pas à en parler à votre médecin.
Votre médecin pratiquera les examens biologiques appropriés afin de vérifier que vous présentez le taux plasmatique souhaité de facteur VIII. Ceci est particulièrement important en cas de chirurgie majeure.
Utilisation chez les enfants et les adolescents (de 0 à 18 ans)
Pour le traitement des saignements, la posologie chez les patients pédiatriques ne diffère pas de celle des patients adultes. Pour la prévention des saignements chez les patients de moins de 6 ans, les doses recommandées sont de 20 à 50 UI par kg de poids corporel 3 à 4 fois par semaine. L'administration d'ADVATE chez les enfants (par voie intraveineuse) ne diffère pas de l’administration chez les adultes. Un dispositif d'accès veineux central (DAVC) peut s'avérer nécessaire afin de permettre des perfusions fréquentes de facteur VIII.
Comment administrer ADVATE ?
ADVATE est injecté dans une veine (par voie intraveineuse) soit par votre médecin ou votre infirmière. Vous ou une autre personne peut aussi vous administrer ADVATE par voie intraveineuse mais seulement après avoir suivi une formation appropriée. Les instructions détaillées pour une auto‑administration sont données à la fin de cette notice.
Si vous avez utilisé plus d'ADVATE que vous n’auriez dû :
Il est recommandé d’utiliser ADVATE exactement comme votre médecin vous l’a dit. Vous devez vérifier avec votre médecin si vous n’êtes pas sûr. Si vous avez reçu plus d’ADVATE que vous n’auriez dû, informez immédiatement votre médecin.
Si vous oubliez de prendre ADVATE :
Ne vous injectez pas une double dose pour compenser la dose que vous avez oublié de prendre. Procédez à l'injection suivante prévue puis continuez comme indiqué par votre médecin.
Si vous arrêtez de prendre ADVATE :
Ne pas interrompre le traitement d’ADVATE sans consulter votre médecin.
Si vous avez des questions concernant l'utilisation de ce médicament, demandez conseil à votre médecin
Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, mais ils ne surviennent pas systématiquement chez tout le monde.
En cas de survenue de réactions allergiques (anaphylactiques) soudaines et graves, arrêtez immédiatement l'injection.
Consultez immédiatement votre médecin en cas d’apparition de signes précoces des réactions allergiques telles que :
- éruption cutanée, urticaire, érythème, éruption prurigineuse généralisée,
- gonflement des lèvres et de la langue,
- difficulté respiratoire, respiration sifflante, oppression thoracique,
- sensation générale de malaise,
- étourdissement, perte de connaissance
Des symptômes sévères tels qu’une difficulté respiratoire extrême, un évanouissement (ou presque) nécessitent immédiatement un traitement d’urgence.
Chez les enfants n’ayant jamais été traités par un médicament contenant du facteur VIII, des inhibiteurs, ou anticorps, (voir rubrique 2) peuvent apparaître de façon très fréquente (plus d’1 personne sur 10). Cependant, chez les patients ayant déjà reçu un traitement par un médicament contenant du facteur VIII pendant plus de 150 jours, ce risque est peu fréquent (moins d’1 personne sur 100). En cas d’apparition d’inhibiteurs, le traitement cessera d’être efficace et vous, ou votre enfant, pourriez avoir un saignement persistant. Dans ce cas, consultez immédiatement votre médecin.
Effets indésirables très fréquents (peuvent toucher plus d’1 personne sur 10)
inhibiteurs du facteur VIII (chez les enfants n’ayant jamais été traités par un médicament contenant du facteur VIII).
Effets indésirables fréquents (peuvent toucher jusqu'à 1 personne sur 10)
maux de tête et fièvre.
Effets indésirables peu fréquents (peuvent toucher jusqu'à 1 personne sur 100)
inhibiteurs du facteur VIII (chez les patients ayant déjà reçu un traitement par un médicament contenant du facteur VIII (pendant plus de 150 jours)), vertiges, grippe, évanouissements, battements cardiaques anormaux, bosses rouges qui grattent sur la peau, inconfort thoracique, bleus au site d’injection, réaction au site d’injection, démangeaisons, transpiration augmentée, goût inhabituel dans la bouche, bouffées de chaleur, migraines, troubles de la mémoire, frissons, diarrhées, nausées, vomissements, essoufflement, mal de gorge, infection des vaisseaux lymphatiques, blanchissement de la peau, inflammation oculaire, rashs, transpiration excessive, gonflement des pieds et des jambes, diminution de l’hématocrite, augmentation d’un certain type de globules blancs (monocytes) et douleur dans la partie supérieure de l’abdomen ou la partie inférieure de la poitrine.
Liés à une intervention chirurgicale :
infection liée au cathéter, baisse du taux de globules rouges, gonflement des membres et des articulations, saignement prolongé après retrait du drain, diminution du taux de facteur VIII et hématome postopératoire.
Liés aux dispositifs d'accès veineux central (DAVC)
infection liée au cathéter, infection systémique et caillot sanguin local au site du cathéter.
Effets indésirables de fréquence indéterminée (la fréquence ne peut être estimée à partir des données disponibles)
réactions mettant potentiellement en jeu le pronostic vital (anaphylaxie) et autres réactions allergiques (hypersensibilité), troubles généraux (fatigue, manque d'énergie).
Effets indésirables supplémentaires chez les enfants
Outre le développement d’inhibiteurs chez des patients pédiatriques non préalablement traités (PUPs), et les complications liées au cathéter, aucune différence d’effets indésirables liée à l’âge n'a été constatée au cours des études cliniques.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via :
Belgique
Agence fédérale des médicaments et des produits de santé
Division Vigilance
Avenue Galilée 5/03 | Boîte Postale 97 |
Site internet: www.notifieruneffetindesirable.be
e-mail: adr@afmps.be
Luxembourg
Centre Régional de Pharmacovigilance de Nancy
Bâtiment de Biologie Moléculaire et de Biopathologie (BBB)
CHRU de Nancy – Hôpitaux de Brabois
Rue du Morvan
54 511 VANDOEUVRE LES NANCY CEDEX
Tél: (+33) 3 83 65 60 85 / 87
e-mail: crpv@chru-nancy.fr
ou
Direction de la Santé
Division de la Pharmacie et des Médicaments
20, rue de Bitbourg
L-1273 Luxembourg-Hamm
Tél.: (+352) 2478 5592
e-mail: pharmacovigilance@ms.etat.lu
Link pour le formulaire : https://guichet.public.lu/fr/entreprises/sectoriel/sante/medecins/notification-effets-indesirables-medicaments.html
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption figurant sur l’étiquette après la mention EXP. La date de péremption se rapporte au dernier jour du mois.
A conserver au réfrigérateur (entre +2ºC et +8ºC).
Ne pas congeler.
Pendant la durée de conservation, la plaquette contenant le produit peut être conservée à température ambiante (ne dépassant pas 25 °C) pendant une période unique de 6 mois maximum. Dans ce cas, ce médicament expire à la fin de la période de 6 mois ou à la date d’expiration imprimée sur la plaquette si celle-ci précède la fin de cette période de 6 mois. Noter la date de fin des 6 mois de conservation à température ambiante sur l’emballage. Une fois le produit conservé à température ambiante, il ne doit pas être remis au réfrigérateur.
Conserver la plaquette contenant le produit dans l’emballage extérieur à l'abri de la lumière.
Ce produit est à usage unique. Toute solution non utilisée doit être éliminée de manière appropriée.
Utiliser le produit immédiatement lorsque la poudre est complètement dissoute.
Ne pas réfrigérer la solution après préparation.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient ADVATE
- La substance active est l’octocog alfa (facteur VIII de coagulation humain produit par la technique de l’ADN recombinant.). Chaque flacon de poudre contient nominalement 250, 500, 1000, 1500, 2000 ou 3000 UI d’octocog alfa.
- Les autres composants sont : mannitol, chlorure de sodium, histidine, tréhalose, chlorure de calcium, trométamol, polysorbate 80 et glutathion (réduit).
Flacon de solvant : 5 ml d’eau pour préparations injectables stérilisée
Qu’est ce qu’ADVATE et contenu de l’emballage extérieur
ADVATE est une poudre friable de couleur blanche à légèrement grise. Après reconstitution, la solution est claire, limpide et exempte de particules.
Titulaire de l’Autorisation de mise sur le marché :
Takeda Manufacturing Austria AG
Industriestrasse 67
A‑1221Vienne
Tél: +800 66838470
e-mail: medinfoEMEA@takeda.com
Fabricants :
Baxalta Belgium Manufacturing SA
Boulevard René Branquart 80
B‑7860 Lessines
Belgique
Pour toute information complémentaire concernant ce médicament, veuillez prendre contact avec le représentant local du titulaire de l’autorisation de mise sur le marché :
België/Belgique/Belgien | Lietuva | ||
България | Luxembourg/Luxemburg | ||
Česká republika | Magyarország | ||
Danmark | Malta | ||
Deutschland | Nederland | ||
Eesti | Norge | ||
Ελλάδα | Österreich | ||
España | Polska | ||
France | Portugal | ||
Hrvatska | România | ||
Ireland | Slovenija | ||
Ísland | Slovenská republika | ||
Italia | Suomi/Finland | ||
Κύπρος | Sverige | ||
Latvija | United Kingdom (Northern Ireland) | ||
La dernière date à laquelle cette notice a été révisée est le 07/2022.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’Agence européenne du médicament http://www.ema.europa.eu/.
‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑
Instructions pour la préparation et l’administration
ADVATE ne doit pas être mélangé avec d'autres médicaments ou solvants.
Il est fortement recommandé qu’à chaque administration d’ADVATE, le nom et le numéro de lot du produit soient enregistrés.
Instructions pour la reconstitution
- Ne pas utiliser le produit après la date de péremption indiquée sur les étiquettes et le carton.
- Ne pas utiliser si le couvercle n'est pas complètement scellé sur la plaquette.
- Ne pas réfrigérer la solution après préparation.
1. Si le produit est encore conservé au réfrigérateur, retirer la plaquette scellée (contient les flacons de solvant et de poudre préassemblés avec le système pour reconstitution) du réfrigérateur et la laisser revenir à température ambiante (entre 15 °C et 25 °C).
2. Se laver soigneusement les mains à l'eau chaude et au savon.
3. Ouvrir l'emballage ADVATE en décollant le couvercle. Retirer le système BAXJECT III de la plaquette.
4. Placer ADVATE sur une surface plane avec le flacon de solvant en haut (Fig. 1). Le flacon de solvant porte une bande bleue. Ne retirer le capuchon bleu que lorsque vous serez invité à le faire, ultérieurement.
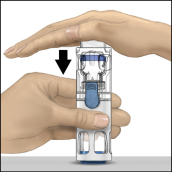
5. Tout en tenant ADVATE d'une main dans le système BAXJECT III, appuyer fermement sur le flacon de solvant de l'autre jusqu'à ce que le système soit entièrement replié et que le solvant s'écoule dans le flacon ADVATE (Fig. 2). N'incliner le système qu'une fois que le transfert est terminé.
6. Vérifier que le transfert de solvant est terminé. Agiter doucement jusqu'à ce que toute la poudre soit dissoute. Bien vérifier que la poudre ADVATE est complètement dissoute, sinon la totalité de la solution reconstituée ne passera pas au travers du filtre. Le produit se dissout rapidement (en général en moins de 1 minute). Après reconstitution, la solution doit être limpide, incolore et exempte de particules.
Fig. 1 | Fig. 2 | Fig. 3 |
|
|
|
Instructions pour l’injection
Des techniques aseptiques sont nécessaires pendant l'administration.
Pour l’administration, il est recommandé d’utiliser une seringue Luer Lock.
Remarque importante
- Ne pas tenter d’injecter à moins d’avoir reçu une formation particulière de votre médecin ou infirmière.
- Inspecter la solution reconstituée avant utilisation pour vérifier l’absence de particules et une coloration éventuelle (la solution doit être limpide, incolore et exempte de particules.)
Ne pas utiliser ADVATE si la solution n’est pas limpide ou la poudre n’est pas complètement dissoute.
1. Retirer l’opercule bleu du système BAXJECT III. Ne pas remplir la seringue d'air. Connecter la seringue au système BAXJECT III.
2. Retourner le système (le flacon contenant la solution reconstituée doit être désormais en position haute). Remplir la seringue avec la solution reconstituée en tirant lentement le piston en arrière.
3. Retirer la seringue.
4. Fixer l’aiguille à ailette à la seringue et injecter la solution reconstituée par voie intraveineuse. La solution devra être administrée lentement à une vitesse d’administration qui devra tenir compte du confort du patient en ne dépassant pas 10 ml/minute. (voir la rubrique 4 "Quels sont les effets indésirables éventuels").
5. Toute solution non utilisée doit être éliminée de manière appropriée.
‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑
Les informations suivantes sont destinées aux professionnels de santé uniquement :
Traitement à la demande
Dans les différentes situations hémorragiques suivantes, l'activité en facteur VIII ne doit pas chuter en dessous de l’activité indiquée (en % de la normale ou en UI/dl) pendant la période concernée. Le tableau suivant peut servir de guide pour les posologies lors d’épisodes hémorragiques ou de chirurgie.
La dose et la fréquence d'administration doivent être adaptées à la réponse clinique de chaque individu. Dans certaines circonstances (ex : présence d’inhibiteur à faible titre), des doses plus importantes que celles calculées peuvent être nécessaires.
Degré de l'hémorragie / type d'intervention chirurgicale | Niveau de Facteur VIII nécessaire (% ou UI/dl) | Fréquence des doses (heures) / durée du traitement (jours) |
Hémorragie | | |
Chirurgie | | |
Notice : Information de l’utilisateur
ADVATE 250 UI poudre et solvant pour solution injectable
ADVATE 500 UI poudre et solvant pour solution injectable
ADVATE 1000 UI poudre et solvant pour solution injectable
ADVATE 1500 UI poudre et solvant pour solution injectable
octocog alfa (facteur VIII de coagulation humain recombinant)
Veuillez lire attentivement l’intégralité de cette notice avant d’utiliser ce médicament car elle contient des informations importantes pour vous.
- Gardez cette notice. Vous pourriez avoir besoin de la relire.
- Si vous avez d’autres questions, interrogez votre médecin.
- Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
- Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
ADVATE contient la substance active octocog alfa, facteur VIII de coagulation humain, produit par la technique de l’ADN recombinant. Le facteur VIII est nécessaire au sang pour former un caillot sanguin et arrêter le saignement. Chez les patients atteints d’hémophilie A (manque congénital de facteur VIII), le facteur VIII est absent ou ne fonctionne pas correctement.
ADVATE est utilisé pour la prévention et le traitement des saignements chez les patients de tous les groupes d'âge atteints d'hémophilie A (trouble héréditaire de la coagulation dû à un manque de facteur VIII).
ADVATE est produit sans addition de protéine d’origine humaine ou animale tout au long de son processus de fabrication.
N’utilisez jamais ADVATE
- si vous êtes allergique à l'octocog alfa, ou à l'un des autres composants contenus dans ce médicament (mentionnés dans la rubrique 6),
- si vous êtes allergique aux protéines de souris ou de hamster.
En cas de doute, n'hésitez pas à demander l'avis de votre médecin.
Avertissements et précautions
Adressez-vous à votre médecin avant d’utiliser ADVATE. Vous devez informer votre médecin, si vous avez été précédemment traité avec un facteur VIII et plus particulièrement si vous avez développé des inhibiteurs, dans la mesure où il existe un risque plus grand qu’ils apparaissent encore. Les inhibiteurs sont des anticorps neutralisants contre le facteur VIIIqui peuvent diminuer l'efficacité d’ADVATE à prévenir et contrôler les saignements. Le développement d’inhibiteurs est une complication connue du traitement de l’hémophilie A. Si votre saignement n’est pas contrôlé avec ADVATE, informez-en immédiatement votre médecin.
Il existe un très faible risque que vous développiez une réaction anaphylactique (réaction allergique soudaine et sévère) à ADVATE. Vous devez être informé des signes précoces des réactions d’hypersensibilité tels qu’éruptions cutanées, urticaire, érythème, éruption prurigineuse généralisée, gonflement des lèvres et de la langue, difficulté respiratoire, respiration sifflante, oppression thoracique, sensation générale de malaise et étourdissement. Ces symptômes peuvent constituer les signes précoces d’un choc anaphylactique, dont la manifestation peut aussi inclure un état vertigineux, une perte de connaissance et une difficulté respiratoire extrême.
Si l’un de ces symptômes apparait, l’injection doit être immédiatement arrêtée et vous devez contacter votre médecin. En cas de symptômes sévères, détresse respiratoire et (presque) évanouissement, un traitement d’urgence devra être instauré.
Patients développant des inhibiteurs du facteur VIII
L’apparition d’inhibiteurs du facteur VIII est une complication connue pouvant survenir pendant le traitement avec un médicament contenant du facteur VIII, peu importe lequel. Ces inhibiteurs, notamment à une forte concentration, empêchent le traitement d’être efficace ; vous ou votre enfant serez donc surveillé étroitement afin de déceler l’apparition de ces inhibiteurs. Si un saignement n’est pas correctement contrôlé avec ADVATE, informez-en immédiatement votre médecin.
Enfants et adolescents
La liste des avertissements et des précautions s’applique aussi bien aux adultes qu’aux enfants (de 0 à 18 ans).
Autres médicaments et ADVATE
Informez votre médecin si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
Grossesse et allaitement
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin avant de prendre ce médicament.
Conduite de véhicules et utilisation de machines
ADVATE n’a aucun effet sur l'aptitude à conduire des véhicules ou à utiliser des machines.
ADVATE contient du sodium
Ce médicament contient 10 mg de sodium (composant principal du sel de cuisine/table) par flacon. Cela équivaut à 0,5 % de l'apport alimentaire quotidien maximal recommandé de sodium pour un adulte.
Administration incorrecte d'ADVATE
Une administration incorrecte (injection dans une artère ou hors de la veine) doit être évitée car des réactions transitoires légères, telles que des bleus et une rougeur, peuvent apparaître au niveau du site d'injection.
Le traitement avec ADVATE sera initié sous la responsabilité d’un médecin expérimenté dans le traitement des patients atteints d’hémophilie A.
Votre médecin calculera la dose d’ADVATE qui vous convient (en unités internationales ou UI) en fonction de votre état clinique et de votre poids, selon qu’il s’agit de la prévention ou du traitement des saignements. La fréquence des administrations dépendra de l’efficacité d’ADVATE sur vous.
Habituellement, le traitement substitutif par ADVATE est un traitement à vie.
Veillez à toujours utiliser ce médicament en suivant exactement les indications de votre médecin. Vérifiez auprès de votre médecin en cas de doute.
Prévention des saignements
La dose habituelle d’octocog alfa se situe entre 20 et 40 UI par kilogramme de poids corporel, administrée tous les 2 à 3 jours.
Toutefois, dans certains cas, surtout chez le sujet jeune, des intervalles plus rapprochés ou des doses plus élevées peuvent être nécessaires.
Traitement des saignements
La dose d’octocog alfa est calculée en fonction de votre poids et du taux de facteur VIII à atteindre.
Le taux de facteur VIII à atteindre dépendra de la sévérité et de la localisation des saignements.
Dose (UI) = poids corporel (kg) x augmentation souhaitée du taux de Facteur VIII (% de la normale) x 0,5
Si vous avez l’impression que l’effet d’ADVATE est insuffisant, n’hésitez pas à en parler à votre médecin.
Votre médecin pratiquera les examens biologiques appropriés afin de vérifier que vous présentez le taux plasmatique souhaité de facteur VIII. Ceci est particulièrement important en cas de chirurgie majeure.
Utilisation chez les enfants et les adolescents (de 0 à 18 ans)
Pour le traitement des saignements, la posologie chez les patients pédiatriques ne diffère pas de celle des patients adultes. Pour la prévention des saignements chez les patients de moins de 6 ans, les doses recommandées sont de 20 à 50 UI par kg de poids corporel 3 à 4 fois par semaine. L'administration d'ADVATE chez les enfants (par voie intraveineuse) ne diffère pas de l’administration chez les adultes. Un dispositif d'accès veineux central (DAVC) peut s'avérer nécessaire afin de permettre des perfusions fréquentes de facteur VIII.
En raison de la baisse de volume d‘injection d'ADVATE reconstitué dans 2 ml, le temps de réaction en cas de réaction d'hypersensibilité pendant l’injection est d'autant plus court. Il est donc conseillé de faire preuve de prudence lors de l‘injection d'ADVATE reconstitué dans 2 ml, en particulier chez l'enfant.
Comment administrer ADVATE ?
ADVATE est injecté dans une veine (par voie intraveineuse) soit par votre médecin ou votre infirmière. Vous ou une autre personne peut aussi vous administrer ADVATE par voie intraveineuse mais seulement après avoir suivi une formation appropriée. Les instructions détaillées pour une auto‑administration sont données à la fin de cette notice.
Si vous avez utilisé plus d'ADVATE que vous n’auriez dû :
Il est recommandé d’utiliser ADVATE exactement comme votre médecin vous l’a dit. Vous devez vérifier avec votre médecin si vous n’êtes pas sûr. Si vous avez reçu plus d’ADVATE que vous n’auriez dû, informez immédiatement votre médecin.
Si vous oubliez de prendre ADVATE :
Ne vous injectez pas une double dose pour compenser la dose que vous avez oublié de prendre. Procédez à l'injection suivante prévue puis continuez comme indiqué par votre médecin.
Si vous arrêtez de prendre ADVATE :
Ne pas interrompre le traitement d’ADVATE sans consulter votre médecin.
Si vous avez des questions concernant l'utilisation de ce médicament, demandez conseil à votre médecin
Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, mais ils ne surviennent pas systématiquement chez tout le monde.
En cas de survenue de réactions allergiques (anaphylactiques) soudaines et graves, arrêtez immédiatement l'injection.
Consultez immédiatement votre médecin en cas d’apparition de signes précoces des réactions allergiques telles que :
- éruption cutanée, urticaire, érythème, éruption prurigineuse généralisée,
- gonflement des lèvres et de la langue,
- difficulté respiratoire, respiration sifflante, oppression thoracique,
- sensation générale de malaise,
- étourdissement, perte de connaissance
Des symptômes sévères tels qu’une difficulté respiratoire extrême, un évanouissement (ou presque) nécessitent immédiatement un traitement d’urgence.
Chez les enfants n’ayant jamais été traités par un médicament contenant du facteur VIII, des inhibiteurs, ou anticorps, (voir rubrique 2) peuvent apparaître de façon très fréquente (plus d’1 personne sur 10). Cependant, chez les patients ayant déjà reçu un traitement par un médicament contenant du facteur VIII pendant plus de 150 jours, ce risque est peu fréquent (moins d’1 personne sur 100). En cas d’apparition d’inhibiteurs, le traitement cessera d’être efficace et vous, ou votre enfant, pourriez avoir un saignement persistant. Dans ce cas, consultez immédiatement votre médecin.
Effets indésirables très fréquents (peuvent toucher plus d’1 personne sur 10)
inhibiteurs du facteur VIII (chez les enfants n’ayant jamais été traités par un médicament contenant du facteur VIII).
Effets indésirables fréquents (peuvent toucher jusqu'à 1 personne sur 10)
maux de tête et fièvre.
Effets indésirables peu fréquents (peuvent toucher jusqu'à 1 personne sur 100)
inhibiteurs du facteur VIII (chez les patients ayant déjà reçu un traitement par un médicament contenant du facteur VIII (pendant plus de 150 jours)), vertiges, grippe, évanouissements, battements cardiaques anormaux, bosses rouges qui grattent sur la peau, inconfort thoracique, bleus au site d’injection, réaction au site d’injection, démangeaisons, transpiration augmentée, goût inhabituel dans la bouche, bouffées de chaleur, migraines, troubles de la mémoire, frissons, diarrhées, nausées, vomissements, essoufflement, mal de gorge, infection des vaisseaux lymphatiques, blanchissement de la peau, inflammation oculaire, rashs, transpiration excessive, gonflement des pieds et des jambes, diminution de l’hématocrite, augmentation d’un certain type de globules blancs (monocytes) et douleur dans la partie supérieure de l’abdomen ou la partie inférieure de la poitrine.
Liés à une intervention chirurgicale :
infection liée au cathéter, baisse du taux de globules rouges, gonflement des membres et des articulations, saignement prolongé après retrait du drain, diminution du taux de facteur VIII et hématome postopératoire.
Liés aux dispositifs d'accès veineux central (DAVC)
infection liée au cathéter, infection systémique et caillot sanguin local au site du cathéter.
Effets indésirables de fréquence indéterminée (la fréquence ne peut être estimée à partir des données disponibles)
réactions mettant potentiellement en jeu le pronostic vital (anaphylaxie) et autres réactions allergiques (hypersensibilité), troubles généraux (fatigue, manque d'énergie).
Effets indésirables supplémentaires chez les enfants
Outre le développement d’inhibiteurs chez des patients pédiatriques non préalablement traités (PUPs), et les complications liées au cathéter, aucune différence d’effets indésirables liée à l’âge n'a été constatée au cours des études cliniques.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via :
Belgique
Agence fédérale des médicaments et des produits de santé
Division Vigilance
Avenue Galilée 5/03 | Boîte Postale 97 |
Site internet: www.notifieruneffetindesirable.be
e-mail: adr@afmps.be
Luxembourg
Centre Régional de Pharmacovigilance de Nancy
Bâtiment de Biologie Moléculaire et de Biopathologie (BBB)
CHRU de Nancy – Hôpitaux de Brabois
Rue du Morvan
54 511 VANDOEUVRE LES NANCY CEDEX
Tél: (+33) 3 83 65 60 85 / 87
e-mail: crpv@chru-nancy.fr
ou
Direction de la Santé
Division de la Pharmacie et des Médicaments
20, rue de Bitbourg
L-1273 Luxembourg-Hamm
Tél.: (+352) 2478 5592
e-mail: pharmacovigilance@ms.etat.lu
Link pour le formulaire : https://guichet.public.lu/fr/entreprises/sectoriel/sante/medecins/notification-effets-indesirables-medicaments.html
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption figurant sur l’étiquette après la mention EXP. La date de péremption se rapporte au dernier jour du mois.
A conserver au réfrigérateur (entre +2ºC et +8ºC).
Ne pas congeler.
Pendant la durée de conservation, le flacon de poudre peut être conservé à température ambiante (ne dépassant pas 25 °C) pendant une période unique de 6 mois maximum. Dans ce cas, ce médicament expire à la fin de la période de 6 mois ou à la date d’expiration imprimée sur le flacon du produit si celle-ci précède la fin de cette période de 6 mois. Noter la date de fin des 6 mois de conservation à température ambiante sur l’emballage. Une fois le produit conservé à température ambiante, il ne doit pas être remis au réfrigérateur.
Conserver le flacon dans l’emballage extérieur à l'abri de la lumière.
Ce produit est à usage unique. Toute solution non utilisée doit être éliminée de manière appropriée.
Utiliser le produit immédiatement lorsque la poudre est complètement dissoute.
Ne pas réfrigérer la solution après préparation.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient ADVATE
- La substance active est l’octocog alfa (facteur VIII de coagulation humain produit par la technique de l’ADN recombinant.). Chaque flacon de poudre contient nominalement 250, 500, 1000 ou 1500 UI d’octocog alfa
- Les autres composants sont : mannitol, chlorure de sodium, histidine, tréhalose, chlorure de calcium, trométamol, polysorbate 80 et glutathion (réduit).
Flacon de solvant : 2 ml d’eau pour préparations injectables stérilisée
Qu’est ce qu’ADVATE et contenu de l’emballage extérieur
ADVATE est une poudre friable de couleur blanche à légèrement grise. Après reconstitution, la solution est claire, limpide et exempte de particules.
Chaque coffret comprend un dispositif pour la reconstitution (BAXJECT II).
Titulaire de l’Autorisation de mise sur le marché :
Takeda Manufacturing Austria AG
Industriestrasse 67
A‑1221Vienne
Tél: +800 66838470
e-mail: medinfoEMEA@takeda.com
Fabricants :
Baxalta Belgium Manufacturing SA
Boulevard René Branquart 80
B‑7860 Lessines
Belgique
Pour toute information complémentaire concernant ce médicament, veuillez prendre contact avec le représentant local du titulaire de l’autorisation de mise sur le marché :
België/Belgique/Belgien | Lietuva | ||
България | Luxembourg/Luxemburg | ||
Česká republika | Magyarország | ||
Danmark | Malta | ||
Deutschland | Nederland | ||
Eesti | Norge | ||
Ελλάδα | Österreich | ||
España | Polska | ||
France | Portugal | ||
Hrvatska | România | ||
Ireland | Slovenija | ||
Ísland | Slovenská republika | ||
Italia | Suomi/Finland | ||
Κύπρος | Sverige | ||
Latvija | United Kingdom (Northern Ireland) | ||
La dernière date à laquelle cette notice a été révisée est le 07/2022.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’Agence européenne du médicament http://www.ema.europa.eu/.
‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑
Instructions pour la préparation et l’administration
Des techniques aseptiques sont nécessaires pendant la reconstitution et l'administration.
Pour la reconstitution, utiliser uniquement l’eau pour préparations injectables stérilisée et le nécessaire de reconstitution et d’administration fournis dans chaque coffret d’ADVATE. ADVATE ne doit pas être mélangé avec d'autres médicaments ou solvants.
Il est fortement recommandé qu’à chaque administration d’ADVATE, le nom et le numéro de lot du produit soient enregistrés.
Instructions pour la reconstitution
- Ne pas utiliser le produit après la date de péremption indiquée sur les étiquettes et le carton.
- Ne pas utiliser si le dispositif BAXJECT II, l’opercule ou l’emballage est endommagé ou présente des signes de détérioration comme indiqué par ce symbole
 .
. - Ne pas réfrigérer la solution après préparation.
1. Si le produit est encore stocké au réfrigérateur, sortir les flacons de poudre ADVATE (poudre) et de solvant du réfrigérateur et laisser les atteindre la température ambiante (entre 15 °C et 25 °C).
2. Lavez‑vous soigneusement les mains à l’eau chaude et au savon.
3. Retirer les opercules des flacons de poudre et de solvant.
4. Nettoyer les bouchons avec les tampons d’alcool. Disposer les flacons sur une surface plane et propre.
5. Ouvrir l’emballage de BAXJECT II en retirant le couvercle sans toucher l’intérieur (Fig. a). Ne pas retirer le dispositif de l’emballage. Ne pas utiliser si le dispositif BAXJECT II, l’opercule ou l’emballage est endommagé ou présente des signes de détérioration.
6. Retourner l’emballage et insérer le perforateur en plastique transparent dans le bouchon du flacon de solvant. Saisir l’emballage sur les côtés puis retirer l’emballage du dispositif BAXJECT II (Fig. b). Ne pas retirer le capuchon bleu du dispositif BAXJECT II.
7. Pour la reconstitution, n’utilisez que l’eau pour préparations injectables stérilisée et le dispositif médical fournis. En maintenant le dispositif BAXJECT II solidaire du flacon de solvant, tourner le système sur lui‑même de sorte que le flacon de solvant se trouve en haut.
Insérer le perforateur en plastique blanc dans le bouchon du flacon de poudre ADVATE. Le vide entraînera le solvant vers le flacon de poudre ADVATE (Fig. c).
8. Agiter doucement jusqu’à ce que toute la poudre soit dissoute. Bien vérifier que la poudre ADVATE est complètement dissoute, sinon la totalité de la solution reconstituée ne passera pas au travers du filtre. Le produit se dissout rapidement (en général en moins d’une minute). Après reconstitution, la solution doit être limpide, incolore et exempte de particules.
Fig. a Fig. b Fig. c
Instructions pour l’injection
Pour l’administration, il est recommandé d’utiliser une seringue Luer Lock.
Remarque importante
- Ne pas tenter d’injecter à moins d’avoir reçu une formation particulière de votre médecin ou infirmière.
- Inspecter la solution reconstituée avant utilisation pour vérifier l’absence de particules et une coloration éventuelle (la solution doit être limpide, incolore et exempte de particules.)
Ne pas utiliser ADVATE si la solution n’est pas limpide ou la poudre n’est pas complètement dissoute.
1. Retirer l’opercule bleu du dispositif BAXJECT II. Ne pas remplir la seringue d'air. Connecter la seringue au dispositif BAXJECT II (Fig. d).
2. Retourner le système (le flacon contenant la solution reconstituée doit être désormais en position haute). Remplir la seringue avec la solution reconstituée en tirant lentement le piston en arrière (Fig. e).
3. Retirer la seringue.
4. Fixer l’aiguille à ailette à la seringue et injecter la solution reconstituée par voie intraveineuse. La solution devra être administrée lentement à une vitesse d’administration qui devra tenir compte du confort du patient en ne dépassant pas 10 ml/minute. (voir la rubrique 4 "Quels sont les effets indésirables éventuels").
5. Toute solution non utilisée doit être éliminée de manière appropriée.
Fig. d Fig. e
‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑
Les informations suivantes sont destinées aux professionnels de santé uniquement :
Traitement à la demande
Dans les différentes situations hémorragiques suivantes, l'activité en facteur VIII ne doit pas chuter en dessous de l’activité indiquée (en % de la normale ou en UI/dl) pendant la période concernée. Le tableau suivant peut servir de guide pour les posologies lors d’épisodes hémorragiques ou de chirurgie.
La dose et la fréquence d'administration doivent être adaptées à la réponse clinique de chaque individu. Dans certaines circonstances (ex : présence d’inhibiteur à faible titre), des doses plus importantes que celles calculées peuvent être nécessaires.
Degré de l'hémorragie / type d'intervention chirurgicale | Niveau de Facteur VIII nécessaire (% ou UI/dl) | Fréquence des doses (heures) / durée du traitement (jours) |
Hémorragie | | |
Chirurgie | | |
Notice : Information de l’utilisateur
ADVATE 250 UI poudre et solvant pour solution injectable
ADVATE 500 UI poudre et solvant pour solution injectable
ADVATE 1000 UI poudre et solvant pour solution injectable
ADVATE 1500 UI poudre et solvant pour solution injectable
octocog alfa (facteur VIII de coagulation humain recombinant)
Veuillez lire attentivement l’intégralité de cette notice avant d’utiliser ce médicament car elle contient des informations importantes pour vous.
- Gardez cette notice. Vous pourriez avoir besoin de la relire.
- Si vous avez d’autres questions, interrogez votre médecin.
- Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
- Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
ADVATE contient la substance active octocog alfa, facteur VIII de coagulation humain, produit par la technique de l’ADN recombinant. Le facteur VIII est nécessaire au sang pour former un caillot sanguin et arrêter le saignement. Chez les patients atteints d’hémophilie A (manque congénital de facteur VIII), le facteur VIII est absent ou ne fonctionne pas correctement.
ADVATE est utilisé pour la prévention et le traitement des saignements chez les patients de tous les groupes d'âge atteints d'hémophilie A (trouble héréditaire de la coagulation dû à un manque de facteur VIII).
ADVATE est produit sans addition de protéine d’origine humaine ou animale tout au long de son processus de fabrication.
N’utilisez jamais ADVATE
- si vous êtes allergique à l'octocog alfa, ou à l'un des autres composants contenus dans ce médicament (mentionnés dans la rubrique 6),
- si vous êtes allergique aux protéines de souris ou de hamster.
En cas de doute, n'hésitez pas à demander l'avis de votre médecin.
Avertissements et précautions
Adressez-vous à votre médecin avant d’utiliser ADVATE. Vous devez informer votre médecin, si vous avez été précédemment traité avec un facteur VIII et plus particulièrement si vous avez développé des inhibiteurs, dans la mesure où il existe un risque plus grand qu’ils apparaissent encore. Les inhibiteurs sont des anticorps neutralisants contre le facteur VIIIqui peuvent diminuer l'efficacité d’ADVATE à prévenir et contrôler les saignements. Le développement d’inhibiteurs est une complication connue du traitement de l’hémophilie A. Si votre saignement n’est pas contrôlé avec ADVATE, informez-en immédiatement votre médecin.
Il existe un très faible risque que vous développiez une réaction anaphylactique (réaction allergique soudaine et sévère) à ADVATE. Vous devez être informé des signes précoces des réactions d’hypersensibilité tels qu’éruptions cutanées, urticaire, érythème, éruption prurigineuse généralisée, gonflement des lèvres et de la langue, difficulté respiratoire, respiration sifflante, oppression thoracique, sensation générale de malaise et étourdissement. Ces symptômes peuvent constituer les signes précoces d’un choc anaphylactique, dont la manifestation peut aussi inclure un état vertigineux, une perte de connaissance et une difficulté respiratoire extrême.
Si l’un de ces symptômes apparait, l’injection doit être immédiatement arrêtée et vous devez contacter votre médecin. En cas de symptômes sévères, détresse respiratoire et (presque) évanouissement, un traitement d’urgence devra être instauré.
Patients développant des inhibiteurs du facteur VIII
L’apparition d’inhibiteurs du facteur VIII est une complication connue pouvant survenir pendant le traitement avec un médicament contenant du facteur VIII, peu importe lequel. Ces inhibiteurs, notamment à une forte concentration, empêchent le traitement d’être efficace ; vous ou votre enfant serez donc surveillé étroitement afin de déceler l’apparition de ces inhibiteurs. Si un saignement n’est pas correctement contrôlé avec ADVATE, informez-en immédiatement votre médecin.
Enfants et adolescents
La liste des avertissements et des précautions s’applique aussi bien aux adultes qu’aux enfants (de 0 à 18 ans).
Autres médicaments et ADVATE
Informez votre médecin si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
Grossesse et allaitement
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin avant de prendre ce médicament.
Conduite de véhicules et utilisation de machines
ADVATE n’a aucun effet sur l'aptitude à conduire des véhicules ou à utiliser des machines.
ADVATE contient du sodium
Ce médicament contient 10 mg de sodium (composant principal du sel de cuisine/table) par flacon. Cela équivaut à 0,5 % de l'apport alimentaire quotidien maximal recommandé de sodium pour un adulte.
Administration incorrecte d'ADVATE
Une administration incorrecte (injection dans une artère ou hors de la veine) doit être évitée car des réactions transitoires légères, telles que des bleus et une rougeur, peuvent apparaître au niveau du site d'injection.
Le traitement avec ADVATE sera initié sous la responsabilité d’un médecin expérimenté dans le traitement des patients atteints d’hémophilie A.
Votre médecin calculera la dose d’ADVATE qui vous convient (en unités internationales ou UI) en fonction de votre état clinique et de votre poids, selon qu’il s’agit de la prévention ou du traitement des saignements. La fréquence des administrations dépendra de l’efficacité d’ADVATE sur vous.
Habituellement, le traitement substitutif par ADVATE est un traitement à vie.
Veillez à toujours utiliser ce médicament en suivant exactement les indications de votre médecin. Vérifiez auprès de votre médecin en cas de doute.
Prévention des saignements
La dose habituelle d’octocog alfa se situe entre 20 et 40 UI par kilogramme de poids corporel, administrée tous les 2 à 3 jours.
Toutefois, dans certains cas, surtout chez le sujet jeune, des intervalles plus rapprochés ou des doses plus élevées peuvent être nécessaires.
Traitement des saignements
La dose d’octocog alfa est calculée en fonction de votre poids et du taux de facteur VIII à atteindre.
Le taux de facteur VIII à atteindre dépendra de la sévérité et de la localisation des saignements.
Dose (UI) = poids corporel (kg) x augmentation souhaitée du taux de Facteur VIII (% de la normale) x 0,5
Si vous avez l’impression que l’effet d’ADVATE est insuffisant, n’hésitez pas à en parler à votre médecin.
Votre médecin pratiquera les examens biologiques appropriés afin de vérifier que vous présentez le taux plasmatique souhaité de facteur VIII. Ceci est particulièrement important en cas de chirurgie majeure.
Utilisation chez les enfants et les adolescents (de 0 à 18 ans)
Pour le traitement des saignements, la posologie chez les patients pédiatriques ne diffère pas de celle des patients adultes. Pour la prévention des saignements chez les patients de moins de 6 ans, les doses recommandées sont de 20 à 50 UI par kg de poids corporel 3 à 4 fois par semaine. L'administration d'ADVATE chez les enfants (par voie intraveineuse) ne diffère pas de l’administration chez les adultes. Un dispositif d'accès veineux central (DAVC) peut s'avérer nécessaire afin de permettre des perfusions fréquentes de facteur VIII.
En raison de la baisse de volume d‘injection d'ADVATE reconstitué dans 2 ml, le temps de réaction en cas de réaction d'hypersensibilité pendant l’injection est d'autant plus court. Il est donc conseillé de faire preuve de prudence lors de l‘injection d'ADVATE reconstitué dans 2 ml, en particulier chez l'enfant.
Comment administrer ADVATE ?
ADVATE est injecté dans une veine (par voie intraveineuse) soit par votre médecin ou votre infirmière. Vous ou une autre personne peut aussi vous administrer ADVATE par voie intraveineuse mais seulement après avoir suivi une formation appropriée. Les instructions détaillées pour une auto‑administration sont données à la fin de cette notice.
Si vous avez utilisé plus d'ADVATE que vous n’auriez dû :
Il est recommandé d’utiliser ADVATE exactement comme votre médecin vous l’a dit. Vous devez vérifier avec votre médecin si vous n’êtes pas sûr. Si vous avez reçu plus d’ADVATE que vous n’auriez dû, informez immédiatement votre médecin.
Si vous oubliez de prendre ADVATE :
Ne vous injectez pas une double dose pour compenser la dose que vous avez oublié de prendre. Procédez à l'injection suivante prévue puis continuez comme indiqué par votre médecin.
Si vous arrêtez de prendre ADVATE :
Ne pas interrompre le traitement d’ADVATE sans consulter votre médecin.
Si vous avez des questions concernant l'utilisation de ce médicament, demandez conseil à votre médecin
Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, mais ils ne surviennent pas systématiquement chez tout le monde.
En cas de survenue de réactions allergiques (anaphylactiques) soudaines et graves, arrêtez immédiatement l'injection.
Consultez immédiatement votre médecin en cas d’apparition de signes précoces des réactions allergiques telles que :
- éruption cutanée, urticaire, érythème, éruption prurigineuse généralisée,
- gonflement des lèvres et de la langue,
- difficulté respiratoire, respiration sifflante, oppression thoracique,
- sensation générale de malaise,
- étourdissement, perte de connaissance
Des symptômes sévères tels qu’une difficulté respiratoire extrême, un évanouissement (ou presque) nécessitent immédiatement un traitement d’urgence.
Chez les enfants n’ayant jamais été traités par un médicament contenant du facteur VIII, des inhibiteurs, ou anticorps, (voir rubrique 2) peuvent apparaître de façon très fréquente (plus d’1 personne sur 10). Cependant, chez les patients ayant déjà reçu un traitement par un médicament contenant du facteur VIII pendant plus de 150 jours, ce risque est peu fréquent (moins d’1 personne sur 100). En cas d’apparition d’inhibiteurs, le traitement cessera d’être efficace et vous, ou votre enfant, pourriez avoir un saignement persistant. Dans ce cas, consultez immédiatement votre médecin.
Effets indésirables très fréquents (peuvent toucher plus d’1 personne sur 10)
inhibiteurs du facteur VIII (chez les enfants n’ayant jamais été traités par un médicament contenant du facteur VIII).
Effets indésirables fréquents (peuvent toucher jusqu'à 1 personne sur 10)
maux de tête et fièvre.
Effets indésirables peu fréquents (peuvent toucher jusqu'à 1 personne sur 100)
inhibiteurs du facteur VIII (chez les patients ayant déjà reçu un traitement par un médicament contenant du facteur VIII (pendant plus de 150 jours)), vertiges, grippe, évanouissements, battements cardiaques anormaux, bosses rouges qui grattent sur la peau, inconfort thoracique, bleus au site d’injection, réaction au site d’injection, démangeaisons, transpiration augmentée, goût inhabituel dans la bouche, bouffées de chaleur, migraines, troubles de la mémoire, frissons, diarrhées, nausées, vomissements, essoufflement, mal de gorge, infection des vaisseaux lymphatiques, blanchissement de la peau, inflammation oculaire, rashs, transpiration excessive, gonflement des pieds et des jambes, diminution de l’hématocrite, augmentation d’un certain type de globules blancs (monocytes) et douleur dans la partie supérieure de l’abdomen ou la partie inférieure de la poitrine.
Liés à une intervention chirurgicale :
infection liée au cathéter, baisse du taux de globules rouges, gonflement des membres et des articulations, saignement prolongé après retrait du drain, diminution du taux de facteur VIII et hématome postopératoire.
Liés aux dispositifs d'accès veineux central (DAVC)
infection liée au cathéter, infection systémique et caillot sanguin local au site du cathéter.
Effets indésirables de fréquence indéterminée (la fréquence ne peut être estimée à partir des données disponibles)
réactions mettant potentiellement en jeu le pronostic vital (anaphylaxie) et autres réactions allergiques (hypersensibilité), troubles généraux (fatigue, manque d'énergie).
Effets indésirables supplémentaires chez les enfants
Outre le développement d’inhibiteurs chez des patients pédiatriques non préalablement traités (PUPs), et les complications liées au cathéter, aucune différence d’effets indésirables liée à l’âge n'a été constatée au cours des études cliniques.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via :
Belgique
Agence fédérale des médicaments et des produits de santé
Division Vigilance
Avenue Galilée 5/03 | Boîte Postale 97 |
Site internet: www.notifieruneffetindesirable.be
e-mail: adr@afmps.be
Luxembourg
Centre Régional de Pharmacovigilance de Nancy
Bâtiment de Biologie Moléculaire et de Biopathologie (BBB)
CHRU de Nancy – Hôpitaux de Brabois
Rue du Morvan
54 511 VANDOEUVRE LES NANCY CEDEX
Tél: (+33) 3 83 65 60 85 / 87
e-mail: crpv@chru-nancy.fr
ou
Direction de la Santé
Division de la Pharmacie et des Médicaments
20, rue de Bitbourg
L-1273 Luxembourg-Hamm
Tél.: (+352) 2478 5592
e-mail: pharmacovigilance@ms.etat.lu
Link pour le formulaire : https://guichet.public.lu/fr/entreprises/sectoriel/sante/medecins/notification-effets-indesirables-medicaments.html
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption figurant sur l’étiquette après la mention EXP. La date de péremption se rapporte au dernier jour du mois.
A conserver au réfrigérateur (entre +2ºC et +8ºC).
Ne pas congeler.
Pendant la durée de conservation, la plaquette contenant le produit peut être conservée à température ambiante (ne dépassant pas 25 °C) pendant une période unique de 6 mois maximum. Dans ce cas, ce médicament expire à la fin de la période de 6 mois ou à la date d’expiration imprimée sur la plaquette si celle-ci précède la fin de cette période de 6 mois. Noter la date de fin des 6 mois de conservation à température ambiante sur l’emballage. Une fois le produit conservé à température ambiante, il ne doit pas être remis au réfrigérateur.
Conserver la plaquette contenant le produit dans l’emballage extérieur à l'abri de la lumière.
Ce produit est à usage unique. Toute solution non utilisée doit être éliminée de manière appropriée.
Utiliser le produit immédiatement lorsque la poudre est complètement dissoute.
Ne pas réfrigérer la solution après préparation.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient ADVATE
- La substance active est l’octocog alfa (facteur VIII de coagulation humain produit par la technique de l’ADN recombinant.). Chaque flacon de poudre contient nominalement 250, 500, 1000 ou 1500 UI d’octocog alfa
- Les autres composants sont : mannitol, chlorure de sodium, histidine, tréhalose, chlorure de calcium, trométamol, polysorbate 80 et glutathion (réduit).
Flacon de solvant : 2 ml d’eau pour préparations injectables stérilisée
Qu’est ce qu’ADVATE et contenu de l’emballage extérieur
ADVATE est une poudre friable de couleur blanche à légèrement grise. Après reconstitution, la solution est claire, limpide et exempte de particules.
Titulaire de l’Autorisation de mise sur le marché :
Takeda Manufacturing Austria AG
Industriestrasse 67
A‑1221Vienne
Tél: +800 66838470
e-mail: medinfoEMEA@takeda.com
Fabricants :
Baxalta Belgium Manufacturing SA
Boulevard René Branquart 80
B‑7860 Lessines
Belgique
Pour toute information complémentaire concernant ce médicament, veuillez prendre contact avec le représentant local du titulaire de l’autorisation de mise sur le marché :
België/Belgique/Belgien | Lietuva | ||
България | Luxembourg/Luxemburg | ||
Česká republika | Magyarország | ||
Danmark | Malta | ||
Deutschland | Nederland | ||
Eesti | Norge | ||
Ελλάδα | Österreich | ||
España | Polska | ||
France | Portugal | ||
Hrvatska | România | ||
Ireland | Slovenija | ||
Ísland | Slovenská republika | ||
Italia | Suomi/Finland | ||
Κύπρος | Sverige | ||
Latvija | United Kingdom (Northern Ireland) | ||
La dernière date à laquelle cette notice a été révisée est le 07/2022.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’Agence européenne du médicament http://www.ema.europa.eu/.
‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑
Instructions pour la préparation et l’administration
ADVATE ne doit pas être mélangé avec d'autres médicaments ou solvants.
Il est fortement recommandé qu’à chaque administration d’ADVATE, le nom et le numéro de lot du produit soient enregistrés.
Instructions pour la reconstitution
- Ne pas utiliser le produit après la date de péremption indiquée sur les étiquettes et le carton.
- Ne pas utiliser si le couvercle n'est pas complètement scellé sur la plaquette.
- Ne pas réfrigérer la solution après préparation.
1. Si le produit est encore conservé au réfrigérateur, retirer la plaquette scellée (contient les flacons de solvant et de poudre préassemblés avec le système pour reconstitution) du réfrigérateur et la laisser revenir à température ambiante (entre 15 °C et 25 °C).
2. Se laver soigneusement les mains à l'eau chaude et au savon.
3. Ouvrir l'emballage ADVATE en décollant le couvercle. Retirer le système BAXJECT III de la plaquette.
4. Placer ADVATE sur une surface plane avec le flacon de solvant en haut (Fig. 1). Le flacon de solvant porte une bande bleue. Ne retirer le capuchon bleu que lorsque vous serez invité à le faire, ultérieurement.
5. Tout en tenant ADVATE d'une main dans le système BAXJECT III, appuyer fermement sur le flacon de solvant de l'autre jusqu'à ce que le système soit entièrement replié et que le solvant s'écoule dans le flacon ADVATE (Fig. 2). N'incliner le système qu'une fois que le transfert est terminé.
6. Vérifier que le transfert de solvant est terminé. Agiter doucement jusqu'à ce que toute la poudre soit dissoute. Bien vérifier que la poudre ADVATE est complètement dissoute, sinon la totalité de la solution reconstituée ne passera pas au travers du filtre. Le produit se dissout rapidement (en général en moins de 1 minute). Après reconstitution, la solution doit être limpide, incolore et exempte de particules.
Fig. 1 | Fig. 2 | Fig. 3 |
|
|
|
Instructions pour l’injection
Des techniques aseptiques sont nécessaires pendant l'administration.
Pour l’administration, il est recommandé d’utiliser une seringue Luer Lock.
Remarque importante
- Ne pas tenter d’injecter à moins d’avoir reçu une formation particulière de votre médecin ou infirmière.
- Inspecter la solution reconstituée avant utilisation pour vérifier l’absence de particules et une coloration éventuelle (la solution doit être limpide, incolore et exempte de particules.)
Ne pas utiliser ADVATE si la solution n’est pas limpide ou la poudre n’est pas complètement dissoute.
1. Retirer l’opercule bleu du système BAXJECT III. Ne pas remplir la seringue d'air. Connecter la seringue au système BAXJECT III.
2. Retourner le système (le flacon contenant la solution reconstituée doit être désormais en position haute). Remplir la seringue avec la solution reconstituée en tirant lentement le piston en arrière.
3. Retirer la seringue.
4. Fixer l’aiguille à ailette à la seringue et injecter la solution reconstituée par voie intraveineuse. La solution devra être administrée lentement à une vitesse d’administration qui devra tenir compte du confort du patient en ne dépassant pas 10 ml/minute. (voir la rubrique 4 "Quels sont les effets indésirables éventuels").
5. Toute solution non utilisée doit être éliminée de manière appropriée.
‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑
Les informations suivantes sont destinées aux professionnels de santé uniquement :
Traitement à la demande
Dans les différentes situations hémorragiques suivantes, l'activité en facteur VIII ne doit pas chuter en dessous de l’activité indiquée (en % de la normale ou en UI/dl) pendant la période concernée. Le tableau suivant peut servir de guide pour les posologies lors d’épisodes hémorragiques ou de chirurgie.
La dose et la fréquence d'administration doivent être adaptées à la réponse clinique de chaque individu. Dans certaines circonstances (ex : présence d’inhibiteur à faible titre), des doses plus importantes que celles calculées peuvent être nécessaires.
Degré de l'hémorragie / type d'intervention chirurgicale | Niveau de Facteur VIII nécessaire (% ou UI/dl) | Fréquence des doses (heures) / durée du traitement (jours) |
Hémorragie | | |
Chirurgie | | |
PRIX
| Code CNK | Emballage | Prix | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|
| 2955342 | ADVATE 2000UI PULV+SOLV SOL INJ 5 ML(400IU/ML)+KIT | € 1327,95 | Oui | - | - |
| 2955359 | ADVATE 3000UI PULV+SOLV SOL INJ 5 ML(600IU/ML)+KIT | € 1987,22 | Oui | - | - |
| 3342870 | ADVATE 250 UI PULV+SOLV SOL INJ 2 ML(125IU/ML)+KIT | € 162,61 | Oui | - | - |
| 3342888 | ADVATE 500 UI PULV+SOLV SOL INJ 2 ML(250IU/ML)+KIT | € 314,39 | Oui | - | - |
| 3342896 | ADVATE 1000UI PULV+SOLV SOL INJ 2 ML(500IU/ML)+KIT | € 617,94 | Oui | - | - |
| 3342904 | ADVATE 1500UI PULV+SOLV SOL INJ 2 ML(750IU/ML)+KIT | € 1003,32 | Oui | - | - |
| 3342912 | ADVATE 2000UI PULV+SOLV SOL INJ 5 ML(400IU/ML)+KIT | € 1269,2 | Oui | - | - |
| 3342920 | ADVATE 3000UI PULV+SOLV SOL INJ 5 ML(600IU/ML)+KIT | € 1953,16 | Oui | - | - |