1. DENOMINATION DU MÉDICAMENT
ADENURIC 120 mg comprimé pelliculé
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque comprimé contient 120 mg de fébuxostat.
Excipients à effet notoire : Chaque comprimé contient 114,75 mg de lactose (sous forme monohydratée).
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Comprimé pelliculé (comprimé)
Comprimé pelliculé jaune pâle à jaune en forme de gélule avec la gravure « 120 » sur une face.
4. DONNEES CLINIQUES
4.1 Indications thérapeutiques
ADENURIC est indiqué dans le traitement de l’hyperuricémie chronique dans les cas où un dépôt d’urate s’est déjà produit (incluant des antécédents ou la présence de tophus et/ou d’arthrite goutteuse).
ADENURIC est indiqué dans la prévention et le traitement de l’hyperuricémie, chez les patients adultes traités par chimiothérapie pour des hémopathies malignes et à risque intermédiaire ou à haut risque de Syndrome de Lyse Tumorale (TLS).
ADENURIC est indiqué chez l’adulte.
4.2 Posologie et mode d’administration
Posologie
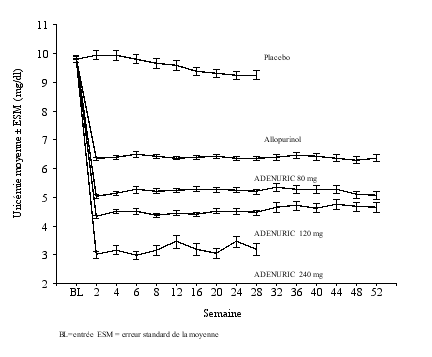
Goutte : La dose recommandée d’ADENURIC est de 80 mg une fois par jour, administrée par voie orale, pendant ou en dehors des repas. Si l’uricémie est > 6 mg/dL (357 µmol/L) après deux à quatre semaines de traitement, l‘administration d’ADENURIC 120 mg une fois par jour peut être envisagée.
L’action d’ADENURIC est suffisamment rapide pour permettre un nouveau dosage de l’uricémie après deux semaines de traitement. L’objectif thérapeutique est la diminution et le maintien de l’uricémie au-dessous de 6 mg/dL (357μmol/L).
Un traitement préventif des crises de goutte est recommandé pendant au moins six mois (voir rubrique 4.4).
Syndrome de Lyse Tumorale : La dose recommandée d’ADENURIC est de 120 mg une fois par jour, administrée par voie orale, pendant ou en dehors des repas.
ADENURIC doit être commencé deux jours avant le début du traitement cytotoxique et poursuivi pour une durée minimum de 7 jours; cependant le traitement peut être prolongé jusqu’à 9 jours selon la durée de la chimiothérapie en fonction de la clinique.
Sujet âgé
Aucune adaptation posologique n’est nécessaire chez les patients âgés (voir rubrique 5.2).
Insuffisance rénale
L’efficacité et la tolérance n’ont pas été totalement évaluées chez les patients présentant une insuffisance rénale sévère (clairance de la créatinine < 30 mL/min) (voir rubrique 5.2).
Aucune adaptation posologique n’est nécessaire chez les patients présentant une insuffisance rénale légère à modérée.
Insuffisance hépatique
L’efficacité et la tolérance du fébuxostat n’ont pas été étudiées chez les patients présentant une insuffisance hépatique sévère (classe C de Child Pugh).
Goutte : La dose recommandée est de 80 mg chez les patients présentant une insuffisance hépatique légère. L’expérience clinique est limitée chez les patients présentant une insuffisance hépatique modérée.
Syndrome de Lyse Tumorale : Dans l’étude pivot de phase III (FLORENCE) seuls les sujets insuffisants hépatiques sévères ont été exclus de l’étude. Aucun ajustement de dose n’a été nécessaire pour les patients participant à l’étude sur la base de leur fonction hépatique.
Population pédiatrique
La sécurité et l’efficacité d’ADENURIC chez les enfants de moins de 18 ans n’ont pas été établies. Aucune donnée n’est disponible.
Mode d’administration
Voie orale.
ADENURIC doit être pris par voie orale et peut être pris au cours ou en dehors des repas.
4.3 Contre-indications
Hypersensibilité à la substance active ou à l’un des excipients listés à la rubrique 6.1 (voir également rubrique 4.8).
4.8 Effets indésirables
Résumé du profil de sécurité
Les effets indésirables les plus fréquemment rapportés au cours des études cliniques (4 072 patients traités par au moins une dose de 10 mg à 300 mg), des études de sécurité post-AMM (étude FAST : 3001 patients traités avec une dose de 80 mg à 120 mg) et après commercialisation chez les patients goutteux sont des crises de gouttes, des anomalies de la fonction hépatique, des diarrhées, des nausées, des maux de tête, des sensations vertigineuses, des dyspnées, des éruptions, du prurit, des arthralgies, des myalgies, des douleurs aux extrémités, des œdèmes et de la fatigue. Ces effets indésirables étaient généralement de sévérité légère ou modérée. De rares réactions graves d’hypersensibilité au fébuxostat, dont certaines étaient associées à des symptômes généraux, ainsi que des évènements rares de mort subite cardiaque, ont été observées après commercialisation.
Liste tabulée des effets indésirables
Les effets indésirables fréquents (≥ 1/100 à < 1/10), peu fréquents (≥ 1/1 000 à < 1/100) et rares (≥ 1/10 000 à < 1/1 000) survenant chez les patients traités par fébuxostat sont mentionnés ci-dessous. Les fréquences sont basées sur des études et après la commercialisation chez des patients atteints de goutte.
Dans chaque groupe de fréquence, les effets indésirables sont présentés par ordre de sévérité décroissante.
Tableau 1 : Effets indésirables lors des études de phase 3, des études d’extension à long terme, des études de sécurité post-AMM et après commercialisation chez les patients atteints de goutte.
Affections hématologiques et système lymphatique | Rare |
Affections du système immunitaire | Rare |
Troubles endocriniens | Peu fréquent |
Affections oculaires | Peu fréquent |
Troubles du métabolisme et de la nutrition | Fréquent*** |
Affections psychiatriques | Peu fréquent |
Affections du système nerveux | Fréquent |
Affections auditives et du labyrinthe | Peu fréquent |
Affections cardiaques | Peu fréquent |
Affections vasculaires | Peu fréquent |
Affections respiratoires | Fréquent |
Affections gastro-intestinales | Fréquent |
Affections hépatobiliaires | Fréquent |
Affections de la peau et du tissu sous-cutané | Fréquent |
Affections musculo-squelettiques et systémiques | Fréquent |
Affections du rein et des voies urinaires | Peu fréquent |
Affections du système de reproduction et des seins | Peu fréquent |
Troubles généraux et anomalies au site d’administration | Fréquent |
Modifications des paramètres biologiques | Peu fréquent |
Lésions, intoxications et complications d’interventions | Peu fréquent |
*Effets indésirables liés au traitement issus des données après commercialisation.
**Les résultats combinés des études de phase 3 ont montré des diarrhées non infectieuses et des anomalies de la fonction hépatique plus fréquentes chez les patients traités de façon concomitante par la colchicine.
***Voir rubrique 5.1 pour l’incidence des crises de goutte dans les études de phase 3 randomisées et contrôlées.
# Effets indésirables provenant des études de sécurité post-AMM
Description des événements indésirables spécifiques
De rares réactions graves d’hypersensibilité au fébuxostat, incluant le syndrome de Stevens-Johnson, une nécrolyse épidermique toxique (syndrome de Lyell), et de réaction/choc anaphylactique ont été observées après commercialisation. Le syndrome de Stevens-Johnson et la nécrolyse épidermique toxique sont caractérisés par une éruption cutanée progressive, accompagnée de bulles ou de lésions des muqueuses et une irritation oculaire. Les réactions d’hypersensibilité au fébuxostat peuvent être associées aux symptômes suivants : réactions cutanées caractérisées par une éruption maculo-papuleuse infiltrée, une éruption généralisée ou exfoliative, mais aussi des lésions cutanées, un œdème de la face, de la fièvre, des anomalies du bilan sanguin telles qu’une thrombocytopénie et une éosinophilie, et atteinte d’un organe unique ou multiviscérale (du foie et des reins incluant une néphrite tubulo-interstitielle) (voir rubrique 4.4).
Les crises de goutte ont fréquemment été observées peu après le début du traitement et au cours des premiers mois. Par la suite, la fréquence des crises de goutte diminue dans le temps. Une prophylaxie des crises de goutte est recommandée (voir rubriques 4.2 et 4.4).
Syndrome de Lyse Tumorale
Résumé du profil de tolérance
Dans l’étude pivot FLORENCE (FLO-01) de phase 3, randomisée, en double aveugle, comparant le febuxostat à l’allopurinol (346 patients sous chimiothérapie pour des hémopathies malignes et à risque intermédiaire ou à haut risque de TLS), seulement 22 (6.4%) sur l’ensemble des patients ont présenté des effets indésirables, à savoir 11 (6.4%) patients dans chaque groupe de traitement. La majorité des effets indésirables étaient légers ou modérés.
Au total, l’étude FLORENCE ne met pas en évidence de problème particulier de tolérance en plus de celle déjà connue avec ADENURIC dans le traitement de la goutte, à l’exception des trois effets indésirables suivants (listés ci-dessus dans le tableau 1).
Affections cardiaques :
Peu fréquent : bloc de branche gauche, tachycardie sinusale.
Affections vasculaires :
Peu fréquent : hémorragie.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de la santé déclarent tout effet indésirable suspecté en Belgique via l'Agence fédérale des médicaments et des produits de santé, Division Vigilance, Boîte Postale 97, B-1000 BRUXELLES, Madou – Site internet: www.notifieruneffetindesirable.be - e-mail: adr@afmps.be et au Luxembourg via le Centre Régional de Pharmacovigilance de Nancy, Bâtiment de Biologie Moléculaire et de Biopathologie (BBB), CHRU de Nancy – Hôpitaux de Brabois, Rue de Morvan, 54 511 Vandoeuvre les Nancy Cedex, tél : (+33) 3 83 65 60 85/87, e-mail : crpv@chru-nancy.fr ou la Direction de la Santé, Division de la Pharmacie et des Médicaments, 20, rue de Bitbourg, L-1273 Luxembourg-Hamm, tél. (+352) 2478 5592, e-mail : pharmacovigilance@ms.etat.lu.
Lien pour le formulaire : https://guichet.public.lu/fr/entreprises/sectoriel/sante/medecins/notification-effets-indesirables-medicaments.html.
7. TITULAIRE DE L'AUTORISATION DE MISE SUR LE MARCHÉ
Menarini International Operations Luxembourg S.A.
1, Avenue de la Gare, L-1611 Luxembourg
Luxembourg
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
EU/1/08/447/003
EU/1/08/447/004
EU/1/08/447/009
EU/1/08/447/010
EU/1/08/447/011
EU/1/08/447/012
EU/1/08/447/019
EU/1/08/447/020
EU/1/08/447/021
EU/1/08/447/022
EU/1/08/447/023
EU/1/08/447/024
10. DATE DE MISE A JOUR DU TEXTE
08/2022
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’Agence européenne du médicament http://www.ema.europa.eu
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 2878403 | ADENURIC 120 MG COMP PELL 84 X 120 MG | M04AA03 | € 31,25 | - | Oui | € 8,04 | € 4,78 |
| 2878429 | ADENURIC 120 MG COMP PELL 28 X 120 MG | M04AA03 | € 19,43 | - | Oui | € 4,69 | € 2,81 |